
¿Cómo diseñar un sistema de ósmosis inversa exitoso?
Comprendiendo la química del agua. Parte 1
Para el correcto diseño y operación de los sistemas de membranas de ósmosis inversa, es indispensable tener presente la analítica del agua a tratar . De igual manera, es sumamente importante reconocer cuales son los principales problemas que se pueden presentar debido a la naturaleza de nuestra agua de partida. En este blog, estudiaremos cuales son los parámetros más importantes a considerar previo a nuestro diseño y durante la operación, en función de variables como el pH y la temperatura. Por cierto si tienes alguna consulta sobre Tratamiento de Aguas por Osmosis Inversa, no dudes en contactarnos.
¡Veamos!
Alcalinidad
Se compone de bicarbonatos, carbonatos y de iones de hidróxido. La alcalinidad reacciona con los ácidos agregados al agua reduciendo el efecto en el cambio de pH a la vez que mientras los carbonatos se transforman en bicarbonatos y los bicarbonatos en dióxido de carbono, en función del pH se puede determinar la proporción de cada uno de estas especies y la forma en que se encuentran en el agua, como se puede observar en la siguiente gráfica. 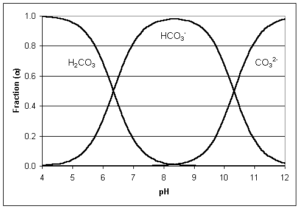
El dióxido de carbono reacciona con el agua en forma de ácido carbónico y no se considera parte de la alcalinidad. Como se puede observar en la gráfica, el dióxido de carbono y el bicarbonato están en un equilibrio entre pH 4.2 y 4.5 en el extremo inferior y entre 8.2 a 8.4 en el extremo superior.
Con valores de pH inferiores a 4,2 a 4,5, la alcalinidad se transforma en dióxido de carbono y a pH de 8,2 a 8,4 toda alcalinidad es bicarbonato.
Si el pH es igual a 9,6 unidades, toda alcalinidad es carbonato. A medida que el pH aumenta por encima de 9,6 se encuentra la alcalinidad en forma de hidroxilo, es decir alcalinidad OH.
Teniendo en cuenta lo anterior a la hora de hacer los ajustes del pH en el agua de alimentación se puede modificar la tendencia incrustante del agua, o reducir el rechazo de CO2 en el permeado, lo que es altamente recomendable en sistemas de Osmosis Inversa.
La determinación de la alcalinidad se hace con la titulación usando como indicadores el naranja de metilo que vira a pH 4,5 y con fenolftaleína de 8,3 unidades. La alcalinidad medida con el naranja de metilo se denomina alcalinidad total o alcalinidad M., y la alcalinidad medida con la fenolftaleína se denomina alcalinidad P. Con la relación de las alcalinidades M y P se puede calcular la alcalinidad OH, y a partir de las tres (M, Py OH), se pueden establecer las concentraciones de Bicarbonatos, carbonatos e hidroxilos.
Aluminio (Al)
La presencia del aluminio en el agua rara vez está asociada a la fuente de agua natural, y por su baja solubilidad es más común encontrarla como coloide resultado de la imposibilidad de precipitar completamente los flóculos de la clarificación, lo cual generaría ensuciamiento coloidal en las membranas de ósmosis inversa por lo que el rango límite del aluminio en el agua de alimentación de la ósmosis va desde 0,1 a 1 ppm.
El rango de pH donde se tiene la menor solubilidad del aluminio es entre 5,5 y 7,5 unidades.
Amonio (NH4)
Las sales de amonio son muy solubles y no causan un problema de incrustación en las membranas de ósmosis.
Dependiendo del pH, la temperatura y la fuerza iónica, se puede tener un diferente nivel de ionización ocasionando una mayor cantidad de ion amonio (NH3) como se puede ver en la siguiente gráfica.
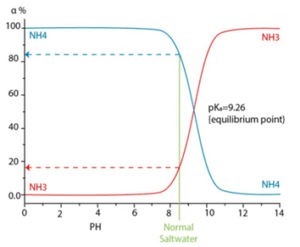
Con altos valores de pH se encuentra el amoniaco como gas, y no es rechazado por la membrana, de forma equivalente a lo que ocurre con el dióxido de carbono. El amonio no se encuentra comúnmente en las fuentes de agua de pozo, ya que generalmente es transformado por actividad microbiana en nitritos y posteriormente oxidado a ion nitratos, que tienen una presencia más amplia. Las fuentes de agua superficial pueden contener amonio al ser contaminadas por sistemas sépticos o por escorrentía de fertilizantes de campos de cultivo.
Bario (Ba)
El sulfato de bario BaSO4 tiene una solubilidad muy baja y puede causar problemas de incrustación en las últimas membranas de la ósmosis inversa. La solubilidad del sulfato de bario se reduce al incrementar la concentración de los sulfatos y a bajas temperaturas. El agua de pozo puede llegar a contener valores de bario de 0,05 ppm a 0,2 ppm, por lo que es necesario que el método de análisis tenga el límite de detección adecuado de hasta 0,01 ppm (10 ppb). Con el uso adecuado de antiescalante se pueden tener valores de saturación entre el 100 y 6.000% controlados.
Bicarbonato (HCO3)
Cuando se encuentra como bicarbonato de calcio, tiene una solubilidad reducida y puede causar problemas de incrustación en los elementos finales de los sistemas de ósmosis inversa. Para determinar la tendencia a incrustar se hace el cálculo del Índice de saturación de Langelier (LSI) para aguas salobres o el índice Stiff-Davis para aguas de mar. La solubilidad del bicarbonato de calcio es mayor al incrementar la temperatura, lo cual debe tenerse en cuenta a la hora de realizar las limpiezas de las membranas. El bicarbonato es un componente de alcalinidad y su concentración está en un equilibrio con el dióxido de carbono entre el rango de pH de 4.4 y 8.2 y en un equilibrio con carbonato entre el rango de pH de 8.2 y 9.6.
Boro (B)
El agua de mar puede contener hasta 5 ppm de boro y su eliminación es un requisito para la potabilización de agua donde se deben tener valores inferiores a 0,5 ppm. El boro se puede encontrar en forma de anión monovalente como borato (H2BO3–) o como ácido bórico (H3BO3) según el pH del agua como se puede observar en la siguiente gráfica.
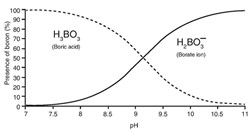
Para lograr una adecuada calidad en el agua permeada se debe tener presente que el rechazo del ion borato es mayor que el rechazo del ácido bórico debido a la carga del primero y al menor tamaño y falta de carga del segundo.
Calcio (Ca)
El calcio, junto con el magnesio, es un componente importante de la dureza en el agua salobre. La solubilidad del sulfato es limitada a 230% usando un antiescalante. Y la solubilidad del carbonato de calcio se limita a los valores del índice de saturación de Langelier (LSI) típicamente, valores positivos entre 1,8 y 2,5. La incrustación del carbonato de calcio es fácilmente identificable por la reacción que tiene con ácidos, que liberan dióxido de carbono y se evidencia con la efervescencia que se observa.

Dióxido de carbono (CO2)
El dióxido de carbono es un gas que cuando se disuelve en agua reacciona con el agua para formar ácido carbónico débil (H2CO3).
La concentración de dióxido de carbono en el agua se determina indirectamente por comparación gráfica con la concentración de bicarbonato y pH, de acuerdo con la gráfica indicada previamente, a partir de estos valores el programa de diseño de ósmosis inversa calcula la concentración de dióxido de carbono.
Como se mencionó previamente, el dióxido de carbono, al ser un gas, no es rechazado por una membrana de ósmosis inversa, y su concentración será la misma en la alimentación, permeado y concentrado.
Al reducir el pH del agua de alimentación y convertir los bicarbonatos en ácido carbónico, se reduce el pH del agua permeada.
Carbonato (C)
La solubilidad del carbonato de calcio es baja y puede generar incrustación en los últimos elementos de la ósmosis inversa. La solubilidad del carbonato de calcio se calcula a partir del índice de saturación de Langelier, para aguas salobres o del SDSI (Índice Stiff-Davis) para aguas de mar, y es menor con el aumento de la temperatura y el aumento pH.
Carbono Orgánico Total (TOC Total Organic Carbon)
Es un ensayo no específico que mide la cantidad de carbono unido en la materia orgánica y se notifica en unidades de “ppm como carbono”.
Dado que el TOC solo mide la cantidad de carbono en la materia orgánica, el peso real de la masa orgánica puede ser hasta 3 veces mayor en las aguas superficiales naturales.
La materia orgánica tiene carga eléctrica negativa en coloides, sólidos suspendidos, compuestos de taninos, lignina, solubles en acido húmico o fúlvico resultantes de la descomposición de cierta materia vegetativa. La materia orgánica natural puede ser un ensuciante para las membranas de RO (osmosis reversa), particularmente las poliamidas compuestas cargadas negativamente. Membranas de RO con carga neutra, como las poliamidas compuestas con carga neutra y el acetato de celulosa, son más resistentes a las incrustaciones orgánicas.
Un RO rechazará más del 99% de los compuestos orgánicos con un peso molecular superior a 200.
Como regla general, los valores máximos para evitar el ensuciamiento orgánico en aguas naturales son:
- Carbono orgánico total: 3 ppm
- DBO a 5 ppm
- DQO a 8 ppm.
Cloruro (Cl)
La solubilidad de las sales de cloruro es alta y no crea un problema de escalado de RO. El cloruro, en el agua de mar, es el anión prevalente. El cloruro es el anión utilizado para equilibrar automáticamente un análisis de agua de alimentación de RO. El límite superior recomendado para el cloruro en el agua potable por la EPA de los Estados Unidos y la OMS es de 250 ppm sobre la base de problemas de sabor.
Conductividad
Es una medida de la capacidad del agua para transmitir electricidad debido a la presencia de iones disueltos, por lo que es un método adecuado para determinar el nivel de iones en un agua de manera indirecta.
Para las aplicaciones donde la conductividad de permeado es muy baja, se requiere que las mediciones de conductividad se realicen in situ al permeado de la RO, ya que los niveles de dióxido de carbono, al ser un gas, pueden variar cuando se exponen a la atmósfera.
DBO (Demanda Biológica de Oxígeno)
Es una prueba no específica de la cantidad de oxígeno requerido por las bacterias durante 5 días a 20°C para oxidar la materia orgánica biodegradable y se expresa como ppm de oxígeno. Altos valores de DBQ incrementan el ensuciamiento de las membranas y pueden hacer necesarias limpiezas más frecuentes y la reducción de la vida útil de las membranas.
DQO (Demanda química de oxígeno)
La DQO es una prueba no específica que mide la cantidad de materia orgánica biodegradable y no biodegradable y se expresa como la cantidad equivalente de oxígeno requerida para oxidar dicha materia orgánica. Altos valores de DOQ incrementan el ensuciamiento de las membranas y pueden hacer necesarias limpiezas más frecuentes y la reducción de la vida útil de las membranas.
Fluoruro (F)
El fluoruro se encuentra naturalmente en niveles bajos en algunas aguas de pozo, pero normalmente su presencia se debe a la inyección en agua municipal para proporcionar un residuo de hasta 2,5 ppm para el control de la caries dental.
El rechazo del fluoruro por una membrana de RO es dependiente del pH, puede llegar al 99% a pH elevados y por debajo de 50% a pH bajos ya que el fluoruro está en forma ácida.
Hierro (Fe)
El hierro es un contaminante del agua que puede encontrarse en su forma soluble ferrosa con valencia +2, en este estado se comporta de manera similar a la dureza del calcio o el magnesio, en el sentido de que puede ser eliminado por suavizantes o se puede controlar su precipitación con dispersantes. En estado Férrico, con valencia +3 los fabricantes recomiendan valores inferiores a 0,05 ppm.
Si todo el hierro está en la forma ferrosa soluble, los niveles de hierro pueden llegar a 0,5 ppm en la alimentación y ser tolerados si el pH es inferior a 7,0 (aunque, de todos modos, se recomienda utilizar un dispersante de hierro).
Al entrar en contacto con aire, el hierro se oxida a férrico generando problemas en los sistemas de ósmosis. Mientras se mantenga soluble puede tratarse con dispersantes o ser removido con filtros, suavizadores o ablandamiento con cal. El hierro insoluble o hidróxidos férricos, al ser de naturaleza coloidal, ensuciarán el extremo frontal del sistema de RO.
El ensuciamiento con hierro incrementa rápidamente la presión de alimentación y la conductividad del permeado. En algunos casos puede fomentar el ensuciamiento biológico al permitir que se incrementen los microrganismos reductores del hierro que generan una película biológica viscosa.
Índice de saturación de Langelier (LSI)
El LSI permite determinar la tendencia incrustante o corrosiva del agua en aguas salobres, basándose en los sólidos disueltos totales y la saturación del carbonato de calcio.
El LSI es importante para los químicos de RO como una medida del potencial de incrustación con carbonato de calcio.
El valor de LSI se puede disminuir al bajar el pH dosificando acido (generalmente sulfúrico o clorhídrico) en el agua de alimentación de RO.
Un LSI recomendado en el concentrado de los sistemas de ósmosis inversa es negativo 0,2 (-0,2). Algunos fabricantes de productos para ósmosis indican que sus productos permiten trabajar con valores de pH de hasta 2,5, pero un diseño más conservador sugiere pH de1,8 como valor máximo.
Índice de saturación de Stiff y Davis (SDSI)
De manera similar a LSI, es un método de cálculo para determinar la tendencia incrustante o corrosiva del agua en agua de mar a partir de los TDS y el nivel de saturación de carbonato de calcio.
La diferencia con respecto al LSI está relacionado con la fuerza iónica dependiente de los sólidos disueltos para el agua de mar y el agua salobre que modifica la solubilidad de las sales.
Como Grupo Mathiesen contamos con un equipo experto y un completo portafolio de productos para tratamientos de agua, puedes conocer más de nuestra de nuestra oferta de soluciones para tratamiento de agua ingresando en este link.















